О2 это: Кислород — Википедия – O2 — Кислород | Химия соединений
Кислород – характеристика элемента, распространённость в природе, физические и химические свойства, получение » HimEge.ru
Кислород О имеет атомный номер 8, расположен в главной подгруппе (подгруппе а) VI группе, во втором периоде. В атомах кислорода валентные электроны размещаются на 2-м энергетическом уровне, имеющем только s— и p-орбитали. Это исключает возможность перехода атомов О в возбуждённое состояние, поэтому кислород во всех соединениях проявляет постоянную валентность, равную II. Имея высокую электроотрицательность, атомы кислорода всегда в соединениях заряжены отрицательно (с.о. = -2 или -1). Исключение – фториды OF2 и O2F2.
Для кислорода известны степени окисления -2, -1, +1, +2
Общая характеристика элемента
Кислород – самый распространенный элемент на Земле, на его долю приходится чуть меньше половины, 49 % от общей массы земной коры. Природный кислород состоит из 3 стабильных изотопов 16О, 17О и 18О (преобладает 16О). Кислород входит в состав атмосферы (20,9 % по объему, 23,2 по массе), в состав воды и более 1400 минералов: кремнезема, силикатов и алюмосиликатов, мраморов, базальтов, гематита и других минералов и горных пород. Кислород составляет 50-85% массы тканей растений и животных, т.к содержится в белках, жирах и углеводах, из которых состоят живые организмы. Общеизвестна роль кислорода для дыхания, для процессов окисления.
Кислород сравнительно мало растворим в воде – 5 объемов в 100 объемах воды. Однако, если бы весь растворенный в воде кислород перешел в атмосферу, то он занял бы огромный объем – 10 млн км3 ( н.у). Это равно примерно 1% всего кислорода в атмосфере. Образование на земле кислородной атмосферы обусловлено процессами фотосинтеза.
Открыт шведом К. Шееле ( 1771 – 1772 г.г) и англичанином Дж. Пристли ( 1774г.). Первый использовал нагревание селитры, второй – оксида ртути (+2). Название дал А.Лавуазье («оксигениум» — «рождающий кислоты»).
В свободном виде существует в двух аллотропных модификациях – «обыкновенного» кислорода О
2 и озона О3.
Строение молекулы озона
3О2 = 2О3 – 285 кДж
Озон в стратосфере образует тонкий слой, который поглощает большую часть биологически вредного ультрафиолетового излучения.
При хранении озон самопроизвольно превращается в кислород. Химически кислород О2 менее активен, чем озон. Электроотрицательность кислорода 3,5.
Физические свойства кислорода
O2 – газ без цвета, запаха и вкуса, т.пл. –218,7 °С, т.кип. –182,96 °С, парамагнитен.
Жидкий O2 голубого, твердый – синего цвета. O2 растворим в воде (лучше, чем азот и водород).
Получение кислорода
1. Промышленный способ — перегонка жидкого воздуха и электролиз воды:
2Н2О → 2Н2 + О2
2. В лаборатории кислород получают:
1.Электролизом щелочных водных растворов или водных растворов кислородосодержащих солей (Na2SO4
2. Термическим разложением перманганата калия KMnO4:
2KMnO4 = K2MnO4 + MnO2 + O2↑,
Бертолетовой соли KClO3:
2KClO3 = 2KCl + 3O2↑ (катализатор MnO2)
Оксида марганца (+4) MnO2:
4MnO2 = 2Mn2O3 + O2↑ (700 oC),
3MnO2 = 2Mn3O4 + O2↑ (1000 oC),
Пероксид бария BaO2 :
2BaO2 = 2BaO + O2↑
3. Разложением пероксида водорода:
2H2O2 = H2O + O2↑ (катализатор MnO2)
4. Разложение нитратов:
2KNO3 → 2KNO2 + O2
На космических кораблях и подводных лодках кислород получают из смеси K2O2 и K2O4:
2K2
O4 + 2H2O = 4KOH +3O2↑
4KOH + 2CO2 = 2K2CO3 + 2H2O
Суммарно:
2K2O4 + 2CO2 = 2K2CO3 + 3О2 ↑
Когда используют K2O2, то суммарная реакция выглядит так:
2K2O2 + 2CO2 = 2K2CO3 + O2 ↑
Если смешать K2O2 и K2O4 в равномолярных (т.е. эквимолярных) количествах, то на 1 моль поглощенного СО2 выделится один моль О2.
Химические свойства кислорода
Кислород поддерживает горение. Горение — быстрый процесс окисления вещества, сопровождающийся выделением большого количества теплоты и света. Чтобы доказать, что в склянке находится кислород, а не какой-то другой газ, надо в склянку опустить тлеющую лучинку. В кислороде тлеющая лучинка ярко вспыхивает. Горение различных веществ на воздухе – это окислительно-восстановительный процесс, в котором окислителем является кислород. Окислители – это вещества, «отбирающие» электроны у веществ-восстановителей. Хорошие окислительные свойства кислорода можно легко объяснить строением его внешней электронной оболочки.
Валентная оболочка кислорода расположена на 2-м уровне – относительно близко к ядру. Поэтому ядро сильно притягивает к себе электроны. На валентной оболочке кислорода 2s2 2p4 находится 6 электронов. Следовательно, до октета недостает двух электронов, которые кислород стремится принять с электронных оболочек других элементов, вступая с ними в реакции в качестве окислителя.
Кислород имеет вторую (после фтора) электроотрицательность в шкале Полинга. Поэтому в подавляющем большинстве своих соединений с другими элементами кислород имеет отрицательную степень окисления. Более сильным окислителем, чем кислород, является только его сосед по периоду – фтор. Поэтому соединения кислорода с фтором – единственные, где кислород имеет положительную степень окисления.
Итак, кислород – второй по силе окислитель среди всех элементов Периодической системы. С этим связано большинство его важнейших химических свойств.
С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород — окислитель.
Кислород легко реагирует с щелочными и щелочноземельными металлами:
4Li + O2 → 2Li2O,
2K + O2 → K2O2,
2Ca + O2 → 2CaO,
2Na + O2 → Na2O2,
2K + 2O2 → K2O4
Мелкий порошок железа ( так называемого пирофорного железа) самовоспламеняется на воздухе, образуя Fe2O3, а стальная проволока горит в кислороде, если ее заранее раскалить:
3 Fe + 2O2 → Fe3O4
2Mg + O2 → 2MgO
2Cu + O2 → 2CuO
С неметаллами (серой, графитом, водородом, фосфором и др.) кислород реагирует при нагревании:
S + O2 → SO2,
C + O2 → CO2,
2H2 + O2 → H2O,
4P + 5O2 → 2P2O5,
Si + O2 → SiO2, и т.д
Почти все реакции с участием кислорода O2 экзотермичны, за редким исключением, например:
N2 + O2 → 2NO – Q
Эта реакция протекает при температуре выше 1200 oC или в электрическом разряде.
Кислород способен окислить сложные вещества, например:
2H2S + 3O2 → 2SO2 + 2H2O (избыток кислорода),
2H2S + O2 → 2S + 2H2O (недостаток кислорода),
4NH3 + 3O2 → 2N2
+ 6H2O (без катализатора),
4NH3 + 5O2 → 4NO + 6H2O (в присутствии катализатора Pt ),
CH4 (метан) + 2O2 → CO2 + 2H2O,
4FeS2 (пирит) + 11O2 → 2Fe2O3 + 8SO2.
Известны соединения, содержащие катион диоксигенила O2+, например, O2+ [PtF6]— (успешный синтез этого соединения побудил Н. Бартлетта попытаться получить соединения инертных газов).
Озон химически более активен, чем кислород O2. Так, озон окисляет иодид — ионы I— в растворе Kl:
O3 + 2Kl + H2O = I2 + O2 + 2KOH
Озон сильно ядовит, его ядовитые свойства сильнее, чем, например, у сероводорода. Однако в природе озон, содержащийся в высоких слоях атмосферы, выполняет роль защитника всего живого на Земле от губительного ультрафиолетового излучения солнца. Тонкий озоновый слой поглощает это излучение, и оно не достигает поверхности Земли. Наблюдаются значительные колебания в толщине и протяженности этого слоя с течением времени (так называемые озоновые дыры) причины таких колебаний пока не выяснены.
Применение кислорода O2: для интенсификации процессов получения чугуна и стали, при выплавке цветных металлов, как окислитель в различных химических производствах, для жизнеобеспечения на подводных кораблях, как окислитель ракетного топлива (жидкий кислород), в медицине, при сварке и резке металлов.
Применение озона О3: для обеззараживания питьевой воды, сточных вод, воздуха, для отбеливания тканей.
Биологическая роль р-элементов VIA группы. Применение их соединений в медицине
Вода — Википедия
| Вода | |||
|---|---|---|---|
| |||
Вода в бассейне({{{изображение}}}) | |||
| Систематическое наименование | Оксид водорода Вода[1] | ||
| Традиционные названия | вода | ||
| Хим. формула | H2O | ||
| Состояние | жидкость | ||
| Молярная масса | 18,01528 г/моль | ||
| Плотность | 0,9982 г/см3[2] | ||
| Твёрдость | 1,5[4] | ||
| Динамическая вязкость | 0,00101 Па·с | ||
| Кинематическая вязкость | 0,01012 см²/с (при 20 °C) | ||
| Скорость звука в веществе | (дистиллированная вода) 1348 м/с | ||
| Температура | |||
| • плавления | 273,1 K (0 ° C) | ||
| • кипения | 373,1 K (99,974 ° C) °C | ||
| • разложения | 2200 °C | ||
| Тройная точка | 273,2 K (0,01 ° C), 611,72 Па | ||
| Критическая точка | 647,1 K (374 ° C), 22,064 МПа | ||
| Мол. теплоёмк. | 75,37 Дж/(моль·К) | ||
| Теплопроводность | 0,56 Вт/(м·K) | ||
| Энтальпия | |||
| • образования | -285,83 кДж/моль | ||
| Удельная теплота испарения | 2256,2 кДж/кг[3] | ||
| Удельная теплота плавления | 332,4 кДж/кг[3] | ||
| Показатель преломления | 1,3945, 1,33432, 1,32612, 1,39336, 1,33298 и 1,32524 | ||
| Рег. номер CAS | 7732-18-5 | ||
| PubChem | 962 | ||
| Рег. номер EINECS | 231-791-2 | ||
| SMILES | |||
| InChI | |||
| RTECS | ZC0110000 | ||
| ChEBI | 15377 | ||
| ChemSpider | 937 | ||
| NFPA 704 |
| ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
 71 % поверхности Земли покрывает вода
71 % поверхности Земли покрывает вода
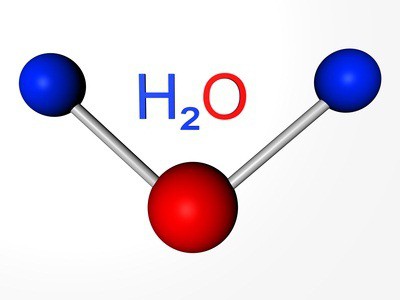
Вода́ (оксид водорода) — бинарное неорганическое соединение с химической формулой H2O: молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. В твёрдом состоянии называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях)[5][6].
Вода является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Исключительно важна роль воды в глобальном кругообороте вещества и энергии[7], возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Вода является важнейшим веществом для всех живых существ на Земле[8].
Всего на Земле около 1400 млн км³ воды. Вода покрывает 71 % поверхности земного шара (океаны, моря, озёра, реки, льды — 361,13 млн км²[9][10]). Бо́льшая часть земной воды (97,54 %) принадлежит Мировому океану — это солёная вода, непригодная для сельского хозяйства и питья. Пресная же вода находится в основном в ледниках (1,81 %) и подземных водах (около 0,63 %), и лишь небольшая часть (0,009 %) в реках и озерах. Материковые солёные воды составляют 0,007 %, в атмосфере содержится 0,001 % от всей воды нашей планеты[11][12].
Происходит от др.-русск. вода, далее от праславянского *voda[13] (ср. ст.-слав. вода, болг. вода́, сербохорв. во̀да, словен. vóda, чеш. voda, слвц. voda, польск. woda, в.-луж., н.-луж. woda), затем от праиндоевропейского *wed-, родственно лит. vanduõ, жем. unduo, д.-в.-н. waʒʒar «вода», гот. watō, англ. water, греч. ὕδωρ, ὕδατος, арм. get «река», фриг. βέδυ, др.-инд. udakám, uda-, udán— «вода», unátti «бить ключом», «орошать», ṓdman— «поток», алб. uj «вода»[14][15]. Также родственно русским словам ведро, выдра. В рамках необщепринятой гипотезы о существовании некогда праностратического языка слово может сравниваться с гипотетическим прауральским *wete (ср., например, фин. vesi, эст. vesi, коми va, венг. víz), а также с предполагаемыми праалтайскими, прадравидийским и пр. словами, и реконструироваться как *wetV для праязыка[16].
С формальной точки зрения вода имеет несколько различных корректных химических названий:
- Оксид водорода: бинарное соединение водорода с атомом кислорода в степени окисления −2, встречается также устаревшее название окись водорода.
- Гидроксид водорода: соединение гидроксильной группы OH— и катиона (H+)
- Гидроксильная кислота: воду можно рассматривать как соединение катиона H+, который может быть замещён металлом, и «гидроксильного остатка» OH—
- Монооксид дигидрогена
- Дигидромонооксид
Физические свойства[править | править код]
Вода при нормальных условиях находится в жидком состоянии, тогда как аналогичные водородные соединения других элементов являются газами (H2S, CH4, HF). Атомы водорода присоединены к атому кислорода, образуя угол 104,45° (104°27′). Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По этой причине молекула воды обладает большим дипольным моментом (p = 1,84 Д, уступает только синильной кислоте и диметилсульфоксиду).
Каждая молекула воды образует до четырёх водородных связей — две из них образует атом кислорода и две — атомы водорода[17].
Количество водородных связей и их разветвлённая структура определяют высокую температуру кипения воды и её удельную теплоту парообразования[17]. Если бы не было водородных связей, вода, на основании места кислорода в таблице Менделеева и температур кипения гидридов аналогичных кислороду элементов (серы, селена, теллура), кипела бы при −80 °С, а замерзала при −100 °С[18].
При переходе в твёрдое состояние молекулы воды упорядочиваются, при этом объёмы пустот между молекулами увеличиваются, и общая плотность воды падает, что и объясняет меньшую плотность (больший объём) воды в фазе льда. При испарении, напротив, все водородные связи рвутся. Разрыв связей требует много энергии, отчего у воды самая большая удельная теплоёмкость среди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один литр воды на один градус, требуется затратить 4,1868 кДж энергии. Благодаря этому свойству вода нередко используется как теплоноситель.
Помимо большой удельной теплоёмкости, вода также имеет большие значения удельной теплоты плавления (333,55 кДж/кг при 0 °C) и парообразования (2250 кДж/кг).
| Температура, °С | Удельная теплоёмкость воды, кДж/(кг*К) |
|---|---|
| -60 (лёд) | 1,64 |
| -20 (лёд) | 2,01 |
| -10 (лёд) | 2,22 |
| 0 (лёд) | 2,11 |
| 0 (чистая вода) | 4,218 |
| 10 | 4,192 |
| 20 | 4,182 |
| 40 | 4,178 |
| 60 | 4,184 |
| 80 | 4,196 |
| 100 | 4,216 |
Физические свойства разных изотопных модификаций воды при различных температурах[19]:
| Модификация воды | Максимальная плотность при температуре, °С | Тройная точка при температуре, °С |
|---|---|---|
| Н2O | 3,9834 | 0,01 |
| D2O | 11,2 | 3,82 |
| T2O | 13,4 | 4,49 |
| Н218O | 4,3 | 0,31 |
Вода обладает также высоким поверхностным натяжением, уступая в этом только ртути[20][21][22]. Относительно высокая вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
Вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде[23]. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Вода обладает отрицательным электрическим потенциалом поверхности.
 Капля, ударяющаяся о поверхность воды
Капля, ударяющаяся о поверхность воды
Чистая вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония H3O+) и гидроксильных ионов OH− составляет 10-7 моль/л.
Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть присутствуют другие положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60 % парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
Агрегатные состояния[править | править код]
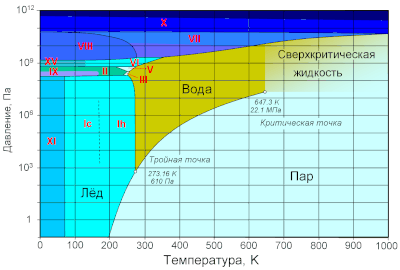
По состоянию различают:

При нормальном атмосферном давлении (760 мм рт. ст., 101 325 Па) вода переходит в твёрдое состояние при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (значения 0 °C и 100 °C были выбраны как соответствующие температурам таяния льда и кипения воды при создании температурной шкалы «по Цельсию»). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такие давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки (сублимации) льда падает со снижением давления. При высоком давлении существуют модификации льда с температурами плавления выше комнатной.
С ростом давления температура кипения воды растёт[24]:
| Давление, атм. | Температура кипения (Ткип), °C |
|---|---|
| 0,987 (105 Па — нормальные условия) | 99,63 |
| 1 | 100 |
| 2 | 120 |
| 6 | 158 |
| 218,5 | 374,1 |
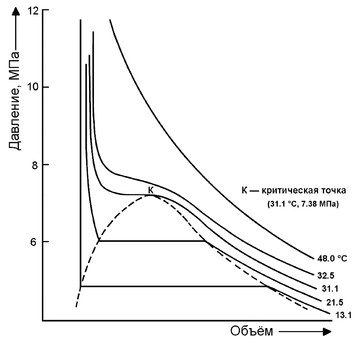
При росте давления плотность насыщенного водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении и/или температуре исчезает разница между жидкой водой и водяным паром. Такое агрегатное состояние называют «сверхкритическая жидкость».
Вода может находиться в метастабильных состояниях — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, можно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Оптические свойства[править | править код]
Они оцениваются по прозрачности воды, которая, в свою очередь, зависит от длины волны излучения, проходящего через воду. Вследствие поглощения оранжевых и красных компонентов света вода приобретает голубоватую окраску. Вода прозрачна только для видимого света и сильно поглощает инфракрасное излучение, поэтому на инфракрасных фотографиях водная поверхность всегда получается чёрной. Ультрафиолетовые лучи легко проходят через воду, поэтому растительные организмы способны развиваться в толще воды и на дне водоёмов, инфракрасные лучи проникают только в поверхностный слой. Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света.
Изотопные модификации[править | править код]
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов водорода, входящих в молекулу, выделяют следующие виды воды:
Последние три вида возможны, так как молекула воды содержит два атома водорода. Протий — самый лёгкий изотоп водорода, дейтерий имеет атомную массу 2,0141017778 а. е. м., тритий — самый тяжёлый, атомная масса 3,0160492777 а. е. м. В воде из-под крана тяжелокислородной воды (H2O17 и H2O18) содержится больше, чем воды D2O16: их содержание, соответственно, 1,8 кг и 0,15 кг на тонну[18].
Хотя тяжёлая вода часто считается мёртвой водой, так как живые организмы в ней жить не могут, некоторые микроорганизмы могут быть приучены к существованию в ней[18].
По стабильным изотопам кислорода 16O, 17O и 18O существуют три разновидности молекул воды. Таким образом, по изотопному составу существуют 18 различных молекул воды. В действительности любая вода содержит все разновидности молекул.
Химические свойства[править | править код]
Вода является наиболее распространённым растворителем на планете Земля, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ.
Её иногда рассматривают как амфолит — и кислоту и основание одновременно (катион H+анион OH−). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ 16.
Вода — химически активное вещество. Сильно полярные молекулы воды сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
Воду можно получать:
- в ходе реакций —
- 2h3O2→2h3O+O2↑{\displaystyle {\mathsf {2H_{2}O_{2}\rightarrow 2H_{2}O+O_{2}\uparrow }}}
- NaHCO3+Ch4COOH→Ch4COONa+h3O+CO2↑{\displaystyle {\mathsf {NaHCO_{3}+CH_{3}COOH\rightarrow CH_{3}COONa+H_{2}O+CO_{2}\uparrow }}}
- 2Ch4COOH+CaCO3→Ca(Ch4COO)2+h3O+CO2↑{\displaystyle {\mathsf {2CH_{3}COOH+CaCO_{3}\rightarrow Ca(CH_{3}COO)_{2}+H_{2}O+CO_{2}\uparrow }}}
- h3SO4+2KOH→K2SO4+2h3O{\displaystyle {\mathsf {H_{2}SO_{4}+2KOH\rightarrow K_{2}SO_{4}+2H_{2}O}}}
- HNO3+Nh5OH→Nh5NO3+h3O{\displaystyle {\mathsf {HNO_{3}+NH_{4}OH\rightarrow NH_{4}NO_{3}+H_{2}O}}}
- 2Ch4COOH+Ba(OH)2→Ba(Ch4COO)2+2h3O{\displaystyle {\mathsf {2CH_{3}COOH+Ba(OH)_{2}\rightarrow Ba(CH_{3}COO)_{2}+2H_{2}O}}}
- Восстановлением водородом оксидов металлов —
- CuO+h3→Cu+h3O{\displaystyle {\mathsf {CuO+H_{2}\rightarrow Cu+H_{2}O}}}
Под воздействием очень высоких температур или электрического тока (при электролизе)[25], а также под воздействием ионизирующего излучения, как установил в 1902 году[26]Фридрих Гизель[en] при исследовании водного раствора бромида радия[27], вода разлагается на молекулярный кислород и молекулярный водород:
- 2h3O→2h3↑+O2↑{\displaystyle {\mathsf {2H_{2}O\rightarrow 2H_{2}\uparrow +O_{2}\uparrow }}}
Вода реагирует при комнатной температуре:
- 2h3O+2Na→2NaOH+h3↑{\displaystyle {\mathsf {2H_{2}O+2Na\rightarrow 2NaOH+H_{2}\uparrow }}}
- со фтором и межгалоидными соединениями
- 2h3O+2F2→4HF+O2{\displaystyle {\mathsf {2H_{2}O+2F_{2}\rightarrow 4HF+O_{2}}}}
- h3O+F2→HF+HOF{\displaystyle {\mathsf {H_{2}O+F_{2}\rightarrow HF+HOF}}} (при низких температурах)
- 3h3O+2IF5→5HF+HIO3{\displaystyle {\mathsf {3H_{2}O+2IF_{5}\rightarrow 5HF+HIO_{3}}}}
- 9h3O+5BrF3→15HF+Br2+3HBrO3{\displaystyle {\mathsf {9H_{2}O+5BrF_{3}\rightarrow 15HF+Br_{2}+3HBrO_{3}}}}
- с солями, образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз
- Al2S3+6h3O→2Al(OH)3↓+3h3S↑{\displaystyle {\mathsf {Al_{2}S_{3}+6H_{2}O\rightarrow 2Al(OH)_{3}\downarrow +3H_{2}S\uparrow }}}
- с ангидридами и галогенангидридами карбоновых и неорганических кислот
- с активными металлорганическими соединениями (диэтилцинк, реактивы Гриньяра, метилнатрий и т. д.)
- с карбидами, нитридами, фосфидами, силицидами, гидридами активных металлов (кальция, натрия, лития и др.)
- со многими солями, образуя гидраты
- с боранами, силанами
- с кетенами, недоокисью углерода
- с фторидами благородных газов
Вода реагирует при нагревании:
- 4h3O+3Fe→Fe3O4+4h3{\displaystyle {\mathsf {4H_{2}O+3Fe\rightarrow Fe_{3}O_{4}+4H_{2}}}}
- h3O+C⇄ CO+h3{\displaystyle {\mathsf {H_{2}O+C\rightleftarrows \ CO+H_{2}}}}
- с некоторыми алкилгалогенидами
Вода реагирует в присутствии катализатора:
- с амидами, эфирами карбоновых кислот
- с ацетиленом и другими алкинами
- с алкенами
- с нитрилами
Волновая функция основного состояния воды[править | править код]
В валентном приближении электронная конфигурация молекулы h3O{\displaystyle {\ce {h3O}}}
Диоксид углерода — Википедия
| Диоксид углерода | |||
|---|---|---|---|
| |||
({{{изображение}}}) | |||
| Систематическое наименование | Диоксид углерода | ||
| Традиционные названия | углекислый газ, углекислота, двуокись углерода, сухой лёд (в твёрдом состоянии) | ||
| Хим. формула | CO2 | ||
| Рац. формула | CO2 | ||
| Состояние | бесцветный газ | ||
| Молярная масса | 44,01 г/моль | ||
| Плотность | газ (0 °C): 1,9768 кг/м³ жидкость (0 °С, 35,5 ат): 925 кг/м³ тв. (−78,5 °C): 1560 кг/м³ | ||
| Динамическая вязкость | 8,5⋅10−5 Па·с (10°C, 5,7 МПа) | ||
| Энергия ионизации | 13,77 ± 0,01 эВ[2] | ||
| Скорость звука в веществе | 269 м/с | ||
| Температура | |||
| • сублимации | −78,5 °C | ||
| Тройная точка | −56,6 °C, 0,52 МПа [1] | ||
| Критическая точка | 31 °C, 7,38 МПа | ||
| Критическая плотность | 467 кг/м³ см³/моль | ||
| Уд. теплоёмк. | 849 Дж/(кг·К) | ||
| Теплопроводность | 0,0166 Вт/(м·K) | ||
| Энтальпия | |||
| • образования | 394 кДж/моль | ||
| • плавления | 9,02 кДж/моль | ||
| • кипения | 16,7 кДж/моль | ||
| • сублимации | 26 кДж/моль | ||
| Удельная теплота испарения | 379,5 кДж/кг | ||
| Удельная теплота плавления | 205 кДж/кг | ||
| Давление пара | 56,5 ± 0,1 атм[2] | ||
| Растворимость | |||
| • в воде | 1,48 кг/м³ | ||
| Рег. номер CAS | 124-38-9 | ||
| PubChem | 280 | ||
| Рег. номер EINECS | 204-696-9 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E290 | ||
| RTECS | FF6400000 | ||
| ChEBI | 16526 | ||
| Номер ООН | 1013 | ||
| ChemSpider | 274 | ||
| Предельная концентрация | 9 000 мг/м3 | ||
| ЛД50 | LC50: 90 000 мг/м3*5 мин (человек, ингаляция) | ||
| Токсичность | Нетоксичен. Опасен лишь в очень больших количествах (обладает удушающим действием). Негорюч. | ||
| Фразы безопасности (S) | S9, S23, S36 | ||
| NFPA 704 |
| ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Диокси́д углеро́да или двуо́кись углеро́да (также углеки́слый газ, углекислотá, окси́д углеро́да(IV), у́гольный ангидри́д) — бесцветный газ (в нормальных условиях), почти без запаха (в больших концентрациях с кисловатым «содовым» запахом), с химической формулой CO2.
Плотность при нормальных условиях 1,98 кг/м³ (в 1,5 раза тяжелее воздуха). При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное (возгонка). Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Концентрация углекислого газа в атмосфере Земли составляет в среднем 0,04 %[3]. Углекислый газ легко пропускает излучение в ультрафиолетовой и видимой частях спектра, которое поступает на Землю от Солнца и обогревает её. В то же время он поглощает испускаемое Землёй инфракрасное излучение и является одним из парниковых газов, вследствие чего должен участвовать в процессе глобального потепления[уточнить]. Изначально, до появления жизни, углекислый газ составлял основу атмосферы Земли и его уровень снижался от десятков процентов до долей одного в результате процесса фотосинтеза. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи[источник не указан 163 дня]. Рост содержания углекислого газа выше, до определённой концентрации, приводит к появлению облаков из углекислоты, что ведет к похолоданию.[4] Оба эти явления объясняют, почему температурные условия существования жизни на Земле относительно стабильны в течение миллиардов лет.
Физические[править | править код]
Оксид углерода (IV) (углекислый газ) — бесцветный газ, при малых концентрациях в воздухе не имеет запаха, при больших концентрациях имеет характерный кисловатый запах газированной воды. Тяжелее воздуха приблизительно в 1,5 раза.
Молекула углекислого газа линейна, расстояние от центра центрального атома углерода до центров двух атомов кислорода 116,3 пм.
При температуре −78,3 °С кристаллизуется в виде белой снегообразной массы — «сухого льда». Сухой лёд при атмосферном давлении не плавится, а испаряется, не переходя в жидкое состояние, температура сублимации −78 °С. Жидкий углекислый газ можно получить при повышении давления. Так, при температуре 20 °С и давлении свыше 6 МПа (~60 атм) газ сгущается в бесцветную жидкость. В спокойном электрическом разряде светится характерным бело-зелёным светом.
Негорюч, но в его атмосфере может поддерживаться горение активных металлов, например, щелочных металлов и щелочноземельных — магния, кальция, бария.
Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Растворим в воде (0,738 объёмов углекислого газа в одном объёме воды при 15 °С).
Химические[править | править код]
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует нестойкую угольную кислоту. Реагирует со щёлочами с образованием её солей — карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Оксид углерода(IV) останавливает горение, вытесняя кислород из зоны реакции. В нём горят только некоторые активные металлы[5]:
- 2Mg+CO2⟶2MgO+C{\displaystyle {\ce {2Mg + CO2 -> 2MgO + C}}}.
Взаимодействие с оксидом активного металла:
- CaO+CO2⟶CaCO3{\displaystyle {\ce {CaO + CO2 -> CaCO3}}}.
При растворении в воде образует равновесную смесь раствора диоксида углерода и угольной кислоты, причём равновесие сильно сдвинуто в сторону разложения кислоты:
- CO2↑+h3O⇄h3CO3{\displaystyle {\ce {CO2\uparrow +h3O\rightleftarrows h3CO3}}}.
Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов:
- Ca(OH)2+CO2⟶CaCO3↓+h3O{\displaystyle {\ce {Ca(OH)2 + CO2 -> CaCO3 v + h3O}}} (качественная реакция на углекислый газ),
- KOH+CO2⟶KHCO3{\displaystyle {\ce {KOH + CO2 -> KHCO3}}}.
Биологические[править | править код]
Организм человека выделяет приблизительно 1 кг углекислого газа в сутки.[6]
Этот углекислый газ переносится от тканей, где он образуется в качестве одного из конечных продуктов метаболизма, по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, уменьшается в капиллярной сети лёгких, и мало в артериальной крови. Содержание углекислого газа в пробе крови часто выражают в терминах парциального давления, то есть давления, которое бы имел содержащийся в пробе крови в данном количестве углекислый газ, если бы весь объём пробы крови занимал только он[7].
Содержание углекислого газа в крови человека приблизительно таково:
Референтные значения или средние значения парциального давления углекислого газа в крови (pCO2) Единицы измерения Газ венозной крови Альвеолярный лёгочный газ Газ артериальной крови кПа 5,5[8]—6,8[8] 4,8 4,7[8]—6,0[8] мм рт. ст. 41—51 36 35[9]—45[9]
Углекислый газ транспортируется в крови тремя различными способами (точное соотношение каждого из этих трёх способов транспортировки зависит от того, является ли кровь артериальной или венозной).
- Бо́льшая часть углекислого газа (от 70 % до 80 %) преобразуется ферментом карбоангидразой эритроцитов в ионы гидрокарбоната[10] при помощи реакции CO2+h3O⟶h3CO3⟶H++HCO3−{\displaystyle {\ce {CO2 + h3O -> h3CO3 -> H^+ + HCO3^-}}}.
- Около 5—10 % углекислого газа растворено в плазме крови[10].
- Около 5—10 % углекислого газа связано с гемоглобином в виде карбаминосоединений (карбогемоглобин)[10].
Гемоглобин, основной кислород-транспортирующий белок эритроцитов крови, способен транспортировать как кислород, так и углекислый газ. Однако углекислый газ связывается с гемоглобином в ином месте, чем кислород. Он связывается с N-терминальными концами цепей глобина, а не с гемом. Однако благодаря аллостерическим эффектам, которые приводят к изменению конфигурации молекулы гемоглобина при связывании, связывание углекислого газа понижает способность кислорода к связыванию с ним же, при данном парциальном давлении кислорода, и наоборот — связывание кислорода с гемоглобином понижает способность углекислого газа к связыванию с ним же, при данном парциальном давлении углекислого газа. Помимо этого, способность гемоглобина к преимущественному связыванию с кислородом или с углекислым газом зависит также и от pH среды. Эти особенности очень важны для успешного захвата и транспорта кислорода из лёгких в ткани и его успешного высвобождения в тканях, а также для успешного захвата и транспорта углекислого газа из тканей в лёгкие и его высвобождения там.
Углекислый газ является одним из важнейших медиаторов ауторегуляции кровотока. Он является мощным вазодилататором. Соответственно, если уровень углекислого газа в ткани или в крови повышается (например, вследствие интенсивного метаболизма — вызванного, скажем, физической нагрузкой, воспалением, повреждением тканей, или вследствие затруднения кровотока, ишемии ткани), то капилляры расширяются, что приводит к увеличению кровотока и соответственно к увеличению доставки к тканям кислорода и транспорта из тканей накопившейся углекислоты. Кроме того, углекислый газ в определённых концентрациях (повышенных, но ещё не достигающих токсических значений) оказывает положительное инотропное и хронотропное действие на миокард и повышает его чувствительность к адреналину, что приводит к увеличению силы и частоты сердечных сокращений, величины сердечного выброса и, как следствие, ударного и минутного объёма крови. Это также способствует коррекции тканевой гипоксии и гиперкапнии (повышенного уровня углекислоты).
Ионы гидрокарбоната очень важны для регуляции pH крови и поддержания нормального кислотно-щелочного равновесия. Частота дыхания влияет на содержание углекислого газа в крови. Слабое или замедленное дыхание вызывает респираторный ацидоз, в то время как учащённое и чрезмерно глубокое дыхание приводит к гипервентиляции и развитию респираторного алкалоза.
Кроме того, углекислый газ также важен в регуляции дыхания. Хотя наш организм требует кислорода для обеспечения метаболизма, низкое содержание кислорода в крови или в тканях обычно не стимулирует дыхание (вернее, стимулирующее влияние нехватки кислорода на дыхание слишком слабо и «включается» поздно, при очень низких уровнях кислорода в крови, при которых человек нередко уже теряет сознание). В норме дыхание стимулируется повышением уровня углекислого газа в крови. Дыхательный центр гораздо более чувствителен к повышению уровня углекислого газа, чем к нехватке кислорода. Как следствие этого, дыхание сильно разрежённым воздухом (с низким парциальным давлением кислорода) или газовой смесью, вообще не содержащей кислорода (например, 100 % азотом или 100 % закисью азота) может быстро привести к потере сознания без возникновения ощущения нехватки воздуха (поскольку уровень углекислоты в крови не повышается, ибо ничто не препятствует её выдыханию). Это особенно опасно для пилотов военных самолётов, летающих на больших высотах (в случае аварийной разгерметизации кабины пилоты могут быстро потерять сознание). Эта особенность системы регуляции дыхания также является причиной того, почему в самолётах стюардессы инструктируют пассажиров в случае разгерметизации салона самолёта в первую очередь надевать кислородную маску самим, прежде чем пытаться помочь кому-либо ещё — делая это, помогающий рискует быстро потерять сознание сам, причём даже не ощущая до последнего момента какого-либо дискомфорта и потребности в кислороде[10].
Дыхательный центр человека пытается поддерживать парциальное давление углекислого газа в артериальной крови не выше 50 мм ртутного столба. При сознательной гипервентиляции содержание углекислого газа в артериальной крови может снизиться до 10—20 мм ртутного столба, при этом содержание кислорода в крови практически не изменится или увеличится незначительно, а потребность сделать очередной вдох уменьшится как следствие уменьшения стимулирующего влияния углекислого газа на активность дыхательного центра. Это является причиной того, почему после некоторого периода сознательной гипервентиляции легче задержать дыхание надолго, чем без предшествующей гипервентиляции. Такая сознательная гипервентиляция с последующей задержкой дыхания может привести к потере сознания до того, как человек ощутит потребность сделать вдох. В безопасной обстановке такая потеря сознания ничем особенным не грозит (потеряв сознание, человек потеряет и контроль над собой, перестанет задерживать дыхание и сделает вдох, дыхание, а вместе с ним и снабжение мозга кислородом восстановятся, а затем восстановится и сознание). Однако в других ситуациях, например, перед нырянием, это может быть опасным (потеря сознания и потребность сделать вдох наступят на глубине, и в отсутствие сознательного контроля в дыхательные пути попадёт вода, что может привести к утоплению)[источник не указан 858 дней]. Именно поэтому гипервентиляция перед нырянием опасна и не рекомендуется.
- В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов[11] (известняк, доломит) или при производстве алкоголя (спиртовое брожение). Смесь полученных газов промывают раствором карбоната калия, которые поглощают углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната чаще применяется водный раствор моноэтаноламина, который при определённых условиях способен абсорбировать CO2{\displaystyle {\ce {CO2}}}, содержащийся в дымовом газе, а при нагреве отдавать его; таким образом отделяется готовый продукт от других веществ.
- Также углекислый газ получают на установках разделения воздуха как побочный продукт получения чистого кислорода, азота и аргона.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой, используя, например, аппарат Киппа[11].
- CaCO3+2HCl⟶CaCl2+h3O+CO2↑{\displaystyle {\ce {CaCO3 + 2HCl -> CaCl2 + h3O + CO2 ^}}}.
Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который замедляет реакцию, и который удаляется значительным избытком кислоты с образованием кислого сульфата кальция.
Для приготовления сухих напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
Также для получения углекислого газа применяется зкзотермическая реакция горения углерода в кислороде[11]:
- C+O2⟶CO2↑+394kJ{\displaystyle {\ce {C + O2 -> CO2 ^ + 394 kJ}}}.
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290.
В криохирургии используется как одно из основных веществ для криоабляции новообразований.
Жидкая углекислота широко применяется в системах пожаротушения и в огнетушителях. Автоматические углекислотные установки для пожаротушения различаются по системам пуска, которые бывают пневматическими, механическими или электрическими.
Устройство для подачи углекислого газа в аквариум может включать в себя резервуар с газом. Простейший и наиболее распространённый метод получения углекислого газа основан на конструкции для изготовления алкогольного напитка браги. При брожении выделяемый углекислый газ вполне может обеспечить подкормку аквариумных растений[12].
Углекислый газ используется для газирования лимонада, газированной воды и других напитков. Углекислый газ используется также в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его распад с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в инертной среде.
Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании.
Хранение углекислоты в стальном баллоне в сжиженном состоянии выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру +31 °С. В стандартный 40-литровый баллон заливают около 20 кг сжиженного углекислого газа, и при комнатной температуре в баллоне будет находиться жидкая фаза, а давление составит примерно 6 МПа (60 кгс/см²). Если температура будет выше +31 °С, то углекислота перейдёт в сверхкритическое состояние с давлением выше 7,36 МПа. Стандартное рабочее давление для обычного 40-литрового баллона составляет 15 МПа (150 кгс/см²), однако он должен безопасно выдерживать давление в 1,5 раза выше, то есть 22,5 МПа, — таким образом, работа с подобными баллонами может считаться вполне безопасной.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле, при ремонте оборудования (например: охлаждение одной из сопрягаемых деталей при их посадке внатяжку) и так далее. Для сжижения углекислого газа и получения сухого льда применяются углекислотные установки.
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO₂ в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта.
Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф. Для измерения низких концентраций CO₂ (а также CO) в технологических газах или в атмосферном воздухе можно использовать газохроматографический метод с метанатором и регистрацией на пламенно-ионизационном детекторе[13].
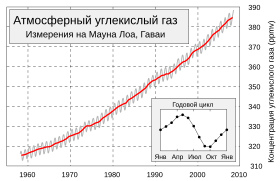
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария.
Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) даёт малый вклад в круговорот углекислоты, а полосы суши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан).
Поэтому с марта по сентябрь вследствие фотосинтеза содержание СО2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемого топлива (угля, нефти, газа), заметно увеличивающееся в зимний сезон[14].
Большое количество углекислоты растворено в океане.
Углекислый газ составляет значительную часть атмосфер некоторых планет Солнечной системы: Венеры, Марса.
Углекислый газ нетоксичен, но при вдыхании его повышенных концентраций в воздухе по воздействию на воздуходышащие живые организмы его относят к удушающим газам (англ.)русск.. По ГОСТу (ГОСТ 8050-85) углекислота относится к IV классу опасности.
Незначительные повышения концентрации, вплоть до 0,2−0,4 % (2000−4000 ppm), в помещениях приводят к развитию у людей сонливости и слабости. Опасными для здоровья концентрациями считаются концентрации около 7−10 %, при которых развиваются симптомы удушья, проявляющиеся в виде головной боли, головокружения, расстройстве слуха и в потере сознания (симптомы, сходные с симптомами высотной болезни), эти симптомы развиваются, в зависимости от концентрации, в течение времени от нескольких минут до одного часа.
Для помещений нормальным является уровень CO₂ около 600 ppm (частей на миллион). Повышенные концентрации углекислого газа снижают когнитивные способности людей. Уже при 1200 ppm расширяются кровеносные сосуды в мозге, снижается активность нейронов и уменьшается объём коммуникации между регионами мозга. [15]. В школьных классах типичной является концентрация 2000−2500, а общий разброс значений — от 1000 до 6000, это вызывает обеспокоенность у исследователей[16], поскольку выявлено снижение результатов учеников, выполняющих тестовые задания в душных помещениях[17].
| Влияние на взрослых здоровых людей | Концентрация углекислого газа, ppm |
|---|---|
| Нормальный уровень на открытом воздухе | 350—450 |
| Приемлемые уровни | <600 |
| Жалобы на несвежий воздух | 600—1000 |
| Максимальный уровень стандартов ASHRAE и OSHA[18] | 1000 |
| Общая вялость | 1000—2500 |
| Возможны нежелательные эффекты на здоровье | 1000—2500 |
| Максимально допустимая концентрация в течение 8 часового рабочего дня | 5000 |
При вдыхании воздуха с очень высокими концентрациями газа смерть наступает очень быстро от удушья, вызванного гипоксией[19].
Несмотря на то, что даже концентрация 5—7 % CO₂ в воздухе несмертельна, но при концентрации 0,1 % (такое содержание углекислого газа иногда наблюдается в воздухе мегаполисов), люди начинают чувствовать слабость, сонливость. Это показывает, что даже при высоком уровне кислорода, большая концентрация CO₂ существенно влияет на самочувствие человека.
| Симптомы у взрослых здоровых людей[20] | Концентрация углекислого газа, ppm |
|---|---|
| Легкое отравление, учащается пульс и частота дыхания, тошнота и рвота | 30 000 |
| Добавляется головная боль и легкое нарушение сознания | 50 000 |
| Потеря сознания, в дальнейшем — смерть | 100 000 |
Вдыхание воздуха с повышенной концентрацией этого газа не приводит к долговременным расстройствам здоровья. После удаления пострадавшего из атмосферы с высокой концентрацией углекислого газа быстро наступает полное восстановление здоровья и самочувствия[21].
- ↑ Carbon Dioxide — Thermophysical Properties
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0103.html
- ↑ Trends in Atmospheric Carbon Dioxide (англ.). National Oceanic and Atmospheric Administration. Дата обращения 24 сентября 2013.
- ↑ Chen Zhou, Mark D. Zelinka & Stephen A. Klein. Impact of decadal cloud variations on the Earth’s energy budget (англ.). Nature Geoscience. Дата обращения 4 декабря 2019.
- ↑ А. С. Егоров. Репетитор по химии — Ростов-на-Дону: «Феникс», 2009.
- ↑ 7. How much carbon dioxide do humans contribute through breathing?. Frequent Questions — Emissions (англ.). US EPA. Дата обращения 4 декабря 2019. Архивировано 2 февраля 2011 года.
- ↑ Charles Henrickson. Chemistry (неопр.). — Cliffs Notes, 2005. — ISBN 0-7645-7419-1.
- ↑ 1 2 3 4 Пересчитано из значений в мм. рт. ст. с использованием коэффициента пересчёта 0,133322 кПа/мм. рт. ст.
- ↑ 1 2 Таблица референсных значений. Юго-Западный медицинский центр при Университете Далласа.
- ↑ 1 2 3 4 Carbon dioxide (неопр.). solarnavigator.net. Дата обращения 12 октября 2007.
- ↑ 1 2 3 Glinka, Nikolaj Leonidovič (1882-1965). Obŝaâ himiâ. — Izd. 27-e ster. — Leningrad: «Himiâ», 1988. — 702, [2] s. с. — ISBN 5724500035, 9785724500036.
- ↑ Большая Энциклопедия Нефти и Газа.
- ↑ ГОСТ 31371.6-2008 (ИСО 6974-6:2002). Газ природный. Определение состава методом газовой хроматографии с оценкой неопределённости. Часть 6. Определение водорода, гелия, кислорода, азота, диоксида углерода и углеводородов C1 — C8 с использованием трёх капиллярных колонок (рус.). Docs.cntd.ru. — М.: Стандартинформ, 2009.. Дата обращения 4 декабря 2019.
- ↑ Бялко А. В. Растения убыстряют рост // Природа. — 1996. — № 10. (по Keeling C.D., Whorf Т.P., Wahlen M., van der Plicht J. // Nature. 1995. V. 375, № 6533. P.666-670)
- ↑ Greenwood, Veronique. Is Conference Room Air Making You Dumber? : [англ.] // The New York Times : газ. — 2019. — 6 May.
- ↑ Ventilation rates and carbon dioxide concentrations in schools. — In: Ventilation with Outdoor Air : [англ.] // Berkeley Lab : [сайт]. — 2019.
- ↑ Сорокин, Андрей. «Глобальное потепление отупляет. От этого уже страдают школьники и офисные работники» // Republic : [сайт]. — 2020. — 7 января.
- ↑ Indoor Air Quality in Commercial and Institutional Buildings
- ↑ (англ.) Carbon Dioxide as a Fire Suppressant: Examining the Risks, U.S. Environmental Protection Agency:.
- ↑ Приемлемые и опасные уровни концентрации углекислого газа (CO2) согласно ASHRAE и OSHA — США. Рекомендованные уровни вентиляции помещений.
- ↑ (англ.) Glatte Jr H. A., Motsay G. J., Welch B. E. Carbon Dioxide Tolerance Studies (неопр.) // Brooks AFB, TX School of Aerospace Medicine Technical Report. — 1967. — Т. SAM—TR—67—77.
Формула кислорода. Периодическая таблица Менделеева
Химический элемент кислород находится во втором периоде VI-ой главной группы устаревшего короткого варианта периодической таблицы. По новым стандартам нумерации — это 16-я группа. Соответствующее решение принято ИЮПАК в 1988 году. Формула кислорода как простого вещества — О2. Рассмотрим его основные свойства, роль в природе и хозяйстве. Начнем с характеристики всей группы периодической системы, которую возглавляет кислород. Элемент отличается от родственных ему халькогенов, а вода отличается от водородных соединений серы, селена и теллура. Объяснение всем отличительным чертам можно найти, только узнав о строении и свойствах атома.
Халькогены — родственные кислороду элементы
Сходные по свойствам атомы образуют одну группу в периодической системе. Кислород возглавляет семейство халькогенов, но отличается от них по ряду свойств.
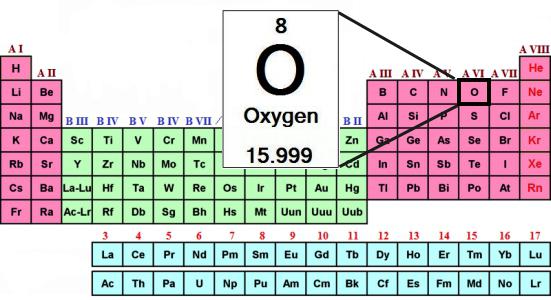
Атомная масса кислорода — родоначальника группы — составляет 16 а. е. м. Халькогены при образовании соединений с водородом и металлами проявляют свою обычную степень окисления: –2. Например, в составе воды (Н2О) окислительное число кислорода равно –2.
Состав типичных водородных соединений халькогенов отвечает общей формуле: Н2R. При растворении этих веществ образуются кислоты. Только водородное соединение кислорода — вода — обладает особыми свойствами. Согласно выводам ученых, это необычное вещество является и очень слабой кислотой, и очень слабым основанием.
Сера, селен и теллур имеют типичные положительные степени окисления (+4, +6) в соединениях с кислородом и другими неметаллами, обладающими высокой электроотрицательностью (ЭО). Состав оксидов халькогенов отражают общие формулы: RO2, RO3. Соответствующие им кислоты имеют состав: H2RO3, H2RO4.
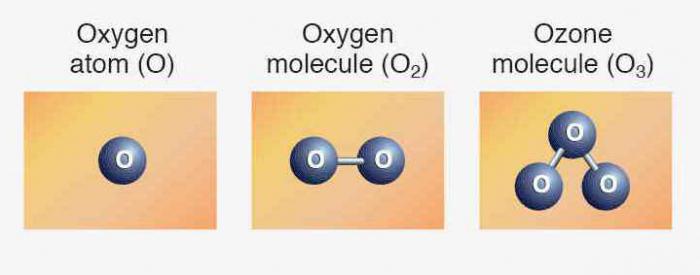
Элементам соответствуют простые вещества: кислород, сера, селен, теллур и полоний. Первые три представителя проявляют неметаллические свойства. Формула кислорода — О2. Аллотропное видоизменение того же элемента — озон (О3). Обе модификации являются газами. Сера и селен — твердые неметаллы. Теллур — металлоидное вещество, проводник электрического тока, полоний — металл.
Кислород — самый распространенный элемент
Общее содержание атомов элемента в земной коре составляет примерно 47 % (по весу). Кислород встречается как в свободном виде, так и в составе многочисленных соединений. Простое вещество, формула которого О2, находится в составе атмосферы, составляя 21 % воздуха (по объему). Молекулярный кислород растворен в воде, находится между частичками почвы.
Мы уже знаем, что есть другая разновидность существования того же самого химического элемента в форме простого вещества. Это озон — газ, образующий на высоте около 30 км от поверхности земли слой, часто называемый озоновым экраном. Связанный кислород входит в молекулы воды, в состав многих горных пород и минералов, органических соединений.
Строение атома кислорода
Периодическая таблица Менделеева содержит полную информацию о кислороде:
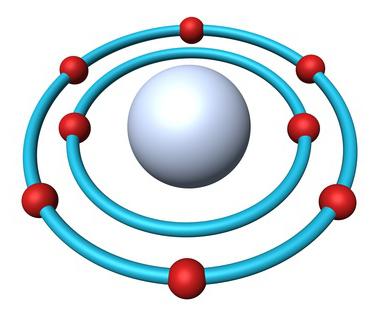
- Порядковый номер элемента — 8.
- Заряд ядра — +8.
- Общее число электронов — 8.
- Электронная формула кислорода — 1s22s22p4.
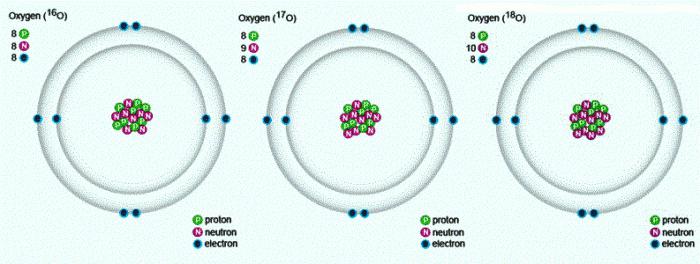
В природе встречаются три стабильных изотопа, которые имеют одинаковый порядковый номер в таблице Менделеева, идентичный состав протонов и электронов, но разное число нейтронов. Обозначаются изотопы одним и тем же символом — О. Для сравнения приведем схему, отражающую состав трех изотопов кислорода:
Свойства кислорода — химического элемента
На 2р-подуровне атома имеются два неспаренных электрона, что объясняет появление степеней окисления –2 и +2. Два спаренных электрона не могут разъединиться, чтобы степень окисления возросла до +4, как у серы и других халькогенов. Причина — отсутствие свободного подуровня. Поэтому в соединениях химический элемент кислород не проявляет валентность и степень окисления, равные номеру группы в коротком варианте периодической системы (6). Обычное для него окислительное число равно –2.
Только в соединениях с фтором кислород проявляет нехарактерную для него положительную степень окисления +2. Значение ЭО двух сильных неметаллов отличается: ЭО (О) = 3,5; ЭО (F) = 4. Как более электроотрицательный химический элемент, фтор сильнее удерживает свои электроны и притягивает валентные частицы на внешнем энергетическом уровне атома кислорода. Поэтому в реакции с фтором кислород является восстановителем, отдает электроны.
Кислород — простое вещество
Английский исследователь Д. Пристли в 1774 году в ходе опытов выделил газ при разложении оксида ртути. Двумя годами ранее это же вещество в чистом виде получил К. Шееле. Лишь спустя несколько лет французский химик А. Лавуазье установил, что за газ входит в состав воздуха, изучил свойства. Химическая формула кислорода — О2. Отразим в записи состава вещества электроны, участвующие в образовании неполярной ковалентной связи — О::О. Заменим каждую связывающую электронную пару одной чертой: О=О. Такая формула кислорода наглядно показывает, что атомы в молекуле связаны между двумя общими парами электронов.

Выполним несложные расчеты и определим, чему равна относительная молекулярная масса кислорода: Mr(O2) = Ar(O) х 2 = 16 х 2 = 32. Для сравнения: Mr(возд.) = 29. Химическая формула кислорода отличается от формулы озона на один атом кислорода. Значит, Mr(O3) = Ar(O) х 3 = 48. Озон в 1,5 раза тяжелее кислорода.
Физические свойства
Кислород — это газ без цвета, вкуса и запаха (при обычной температуре и давлении, равном атмосферному). Вещество немного тяжелее воздуха; растворяется в воде, но в небольших количествах. Температура плавления кислорода является отрицательной величиной и составляет –218,3 °C. Точка, в которой жидкий кислород вновь превращается в газообразный, — это его температура кипения. Для молекул О2 значение этой физической величины достигает –182,96 °C. В жидком и твердом состоянии кислород приобретает светло-синюю окраску.
Получение кислорода в лаборатории
При нагревании кислородосодержащих веществ, например перманганата калия, выделяется бесцветный газ, который можно собрать в колбу или пробирку. Если внести в чистый кислород зажженную лучину, то она горит более ярко, чем в воздухе. Два других лабораторных способа получения кислорода — разложение пероксида водорода и хлората калия (бертолетовой соли). Рассмотрим схему прибора, который применяется для термического разложения.
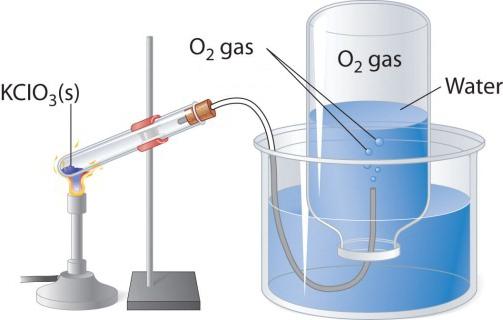
В пробирку или круглодонную колбу надо насыпать немного бертолетовой соли, закрыть пробкой с газоотводной трубочкой. Ее противоположный конец следует направить (под водой) в опрокинутую вверх дном колбу. Горлышко должно быть опущено в широкий стакан или кристаллизатор, наполненный водой. При нагревании пробирки с бертолетовой солью выделяется кислород. По газоотводной трубке он поступает в колбу, вытесняя из нее воду. Когда колба наполнится газом, ее закрывают под водой пробкой и переворачивают. Полученный в этом лабораторном опыте кислород можно использовать для изучения химических свойств простого вещества.
Горение
Если в лаборатории проводится сжигание веществ в кислороде, то нужно знать и соблюдать противопожарные правила. Водород мгновенно сгорает в воздухе, а смешанный с кислородом в соотношении 2:1, он взрывоопасен. Горение веществ в чистом кислороде происходит намного интенсивнее, чем в воздухе. Объясняется это явление составом воздуха. Кислород в атмосфере составляет чуть больше 1/5 части (21%). Горение — это реакция веществ с кислородом, в результате которой образуются разные продукты, в основном оксиды металлов и неметаллов. Пожароопасны смеси О2 с горючими веществами, кроме того, получившиеся соединения могут быть токсичными.
Горение обычной свечки (или спички) сопровождается образованием диоксида углерода. Следующий опыт можно провести в домашних условиях. Если сжигать вещество под стеклянной банкой или большим стаканом, то горение прекратится, как только израсходуется весь кислород. Азот не поддерживает дыхание и горение. Углекислый газ — продукт окисления — больше не вступает в реакцию с кислородом. Прозрачная известковая вода позволяет обнаружить присутствие диоксида углерода после горения свечи. Если пропускать продукты горения через гидроксид кальция, то раствор мутнеет. Происходит химическая реакция между известковой водой и углекислым газом, получается нерастворимый карбонат кальция.

Получение кислорода в промышленных масштабах
Самый дешевый процесс, в результате которого получаются свободные от воздуха молекулы О2, не связан с проведением химических реакций. В промышленности, скажем, на металлургических комбинатах, воздух при низкой температуре и высоком давлении сжижают. Такие важнейшие компоненты атмосферы, как азот и кислород, кипят при разных температурах. Разделяют воздушную смесь при постепенном нагревании до обычной температуры. Сначала выделяются молекулы азота, затем кислорода. Способ разделения основан на разных физических свойствах простых веществ. Формула простого вещества кислорода такая же, как была до охлаждения и сжижения воздуха, — О2.
В результате некоторых реакций электролиза тоже выделяется кислород, его собирают над соответствующим электродом. Газ нужен промышленным, строительным предприятиям в больших объемах. Потребности в кислороде постоянно растут, особенно нуждается в нем химическая промышленность. Хранят полученный газ для производственных и медицинских целей в стальных баллонах, снабженных маркировкой. Емкости с кислородом окрашивают в синий или голубой цвет, чтобы отличать от других сжиженных газов — азота, метана, аммиака.

Химические расчеты по формуле и уравнениям реакций с участием молекул О2
Численное значение молярной массы кислорода совпадает с другой величиной — относительной молекулярной массой. Только в первом случае присутствуют единицы измерения. Коротко формула вещества кислорода и его молярной массы должна быть записана так: М(О2) = 32 г/моль. При нормальных условиях молю любого газа соответствует объем 22,4 л. Значит, 1 моль О2 — это 22,4 л вещества, 2 моль О2 — 44,8 л. По уравнению реакции между кислородом и водородом можно заметить, что взаимодействуют 2 моля водорода и 1 моль кислорода:
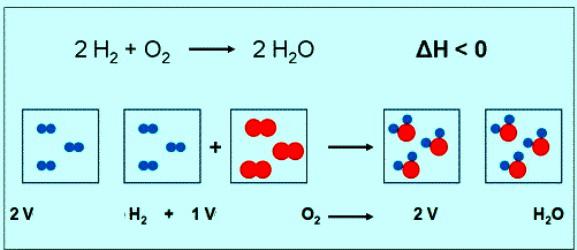
Если в реакции участвует 1 моль водорода, то объем кислорода составит 0,5 моль • 22,4 л/моль = 11,2 л.
Роль молекул О2 в природе и жизни человека
Кислород потребляется живыми организмами на Земле и участвует в круговороте веществ свыше 3 млрд лет. Это главное вещество для дыхания и метаболизма, с его помощью происходит разложение молекул питательных веществ, синтезируется необходимая для организмов энергия. Кислород постоянно расходуется на Земле, но его запасы пополняются благодаря фотосинтезу. Русский ученый К. Тимирязев считал, что благодаря именно этому процессу до сих пор существует жизнь на нашей планете.

Велика роль кислорода в природе и хозяйстве:
- поглощается в процессе дыхания живыми организмами;
- участвует в реакциях фотосинтеза в растениях;
- входит в состав органических молекул;
- процессы гниения, брожения, ржавления протекают при участии кислорода, выступающего в качестве окислителя;
- используется для получения ценных продуктов органического синтеза.
Сжиженный кислород в баллонах используют для резки и сварки металлов при высоких температурах. Эти процессы проводят на машиностроительных заводах, на транспортных и строительных предприятиях. Для проведения работ под водой, под землей, на большой высоте в безвоздушном пространстве люди тоже нуждаются в молекулах О2. Кислородные подушки применяются в медицине для обогащения состава воздуха, вдыхаемого больными людьми. Газ для медицинских целей отличается от технического практически полным отсутствием посторонних примесей, запаха.

Кислород — идеальный окислитель
Известны соединения кислорода со всеми химическими элементами таблицы Менделеева, кроме первых представителей семейства благородных газов. Многие вещества непосредственно вступают в реакции с атомами О, исключая галогены, золото и платину. Большое значение имеют явления с участием кислорода, которые сопровождаются выделением света и тепла. Такие процессы широко используются в быту, промышленности. В металлургии взаимодействие руд с кислородом называют обжигом. Предварительно измельченную руду смешивают с воздухом, обогащенным кислородом. При высоких температурах происходит восстановление металлов из сульфидов до простых веществ. Так получают железо и некоторые цветные металлы. Присутствие чистого кислорода повышает скорость технологических процессов в разных отраслях химии, технике и металлургии.
Появление дешевого способа получения кислорода из воздуха методом разделения на компоненты при низкой температуре стимулировало развитие многих направлений промышленного производства. Химики считают молекулы О2 и атомы О идеальными окислительными агентами. Это естественные материалы, они постоянно возобновляются в природе, не загрязняют окружающую среду. Кроме того, химические реакции с участием кислорода чаще всего завершаются синтезом еще одного натурального и безопасного продукта — воды. Велика роль О2 в обезвреживании токсичных производственных отходов, очистке воды от загрязнений. Кроме кислорода, для обеззараживания используется его аллотропная модификация — озон. Это простое вещество обладает высокой окислительной активностью. При озонировании воды разлагаются загрязняющие вещества. Озон также губительно действует на болезнетворную микрофлору.
О2О маркетинг или ecommerce эволюция по-китайски
Ежегодный онлайн-шопинг фестиваль от Alibaba, который прошел 11 ноября, менее чем за сутки выручил $14,3 млрд. Это в четыре раза больше, чем прибыль американского Киберпонедельника. Однако процесс развития сферы маркетинга в Китае не стоит на месте, и обычной электронной коммерции специалистам отрасли в этой стране уже недостаточно. Они открывают для себя новые перспективы в многоканальной розничной торговле, известной в Китае как «O2O», что означает «онлайн в оффлайн». Цель стратегии – привлечь интернет пользователей в оффлайн-магазины.


«Всякий раз, когда Alibaba устанавливает новый приоритет для Китая, крупнейшего в мире рынка интернет-коммерции, бренды моментально включаются в работу и дело приобретает колоссальный оборот», – прокомментировал Alex Misseri, старший вице-президент розничной торговли и коммерции в Razorfish Asia-Pacific.
Так, например, во время посещения одиного из 180 000 магазинов-партнеров, мобильное приложение от Alibaba предлагало покупателю просканировать специальный код, чтобы поучаствовать в розыгрыше купонов к распродаже 11.11. Разыгрывались купоны на общую сумму $755 млн.
«Еще один прорыв – доставлять заказы из ближайших магазинов, а не с удаленных складов. Благодаря чему время доставки значительно сокращается, и сможет измеряться минутами, а не часами и днями», – добавил Alex Misseri.
Розничные продавцы, у которых есть свои магазины на платформе Tmall от Alibaba, также заинтересованы в развитии направления O2O. Например, Cadillac продают свои автомобили онлайн посредством Tmall, при этом первые 100 покупателей, принявшие участие в акции 11.11, получили ATS-L за полцены. Проект O2O предлагал еще один небольшой бонус: покупатели, посетившие шоу-рум и опубликовавшие фото автомобиля в приложении WeChat, получали дополнительную скидку в $31.
Однако не только в Alibaba сделали ставку на стратегию O2O; другие китайские гиганты, Tencent и Baidu, также борются за первенство в этом сегменте. Robin Li, генеральный директор Baidu, третьей в мире цифровой рекламной платформы после Google and Facebook, даже назвал O2O будущим компании. Сегодня она специализируется в основном на поисковом маркетинге. При этом он выразил сожаление, что западные инвесторы еще не оценили все возможности новой стратегии.
Жесткая конкуренция между китайскими гигантами и их затраты на проекты O2O стали толчком к расцвету мобильных технологий в Китае.
WeChat от Tencent теперь не просто приложение для общения; с помощью него можно купить билеты на самолет, вызвать такси, оплатить счета, сыграть в спонсированную мобильную игру или сделать покупки. (Чтобы убедить пользователей привязать свои банковские карты к WeChat, накануне Китайского Нового года компания запустила ряд популярных социальных игр, вдохновленных традицией дарить в этот день деньги в красных конвертах).
Tencent сотрудничает со вторым крупнейшим в Китае онлайн-ритейлером – JD.com, который, как и Alibaba, организует собственные распродажи 11 ноября. Эта компания владеет платформой онлайн-отзывов и популярным сервисом Dianping, интегрированным с WeChat. С его помощью всего за пару кликов можно заказать обед у повара ($15.50), вызвать на дом мастера маникюра (от $10.70) или попросить кого-нибудь помыть вашу машину ($6.13).
«Создание подобного сервиса стало возможным благодаря низкой стоимости труда в Китае и высокой плотности населения в мегаполисах», – считает Eugene Chew, директор по цифровым технологиям в J. Walter Thompson Shanghai. Люди также находят подобные услуги удобными, так как владельцев личных автомобилей в Китае достаточно мало и не во всех городах широко распространена розничная торговля. Еще один фактор – Китай осваивает новые технологии невероятно быстро.
«Многие перескочили поколение ПК и сразу начали активно использовать смартфоны, поэтому они очень легко осваивают любые нововведения», – добавил Eugene Chew. Уровень жизни в Китае растет вместе с покупательской способностью, поэтому люди готовы открывать для себя новинки и покупать новые вещи, при этом они открыты для маркетинга.
Как бренды и агентства работают со стратегией O2O
Возможности O2O маркетинга могут показаться довольно ограниченными: сколько способов получения мобильных купонов в магазинах можно придумать? Но вот креативные примеры нескольких последних кампаний, в которых агентства проявили фантазию, объединяя онлайн и оффлайн миры.
ECCO
Бренд представил мобильную игру и видео известного travel блогера, испытывающего на прочность свой новый непромокаемый ботинок. Кампания от Wunderman and Agenda привлекла в магазины 34 000 людей, желающих протестировать обувь на прочность и водостойкость. Для этого нужно было пройтись в ней в специальном устройстве в течение трех минут. За время кампании продажи выросли более чем в три раза.


OLAY
В рамках кампания Olay в честь Дня матери от местного агентства Social Touch в WeChat был запущен онлайн-вопросник, помогающий женщинам определить свой тип кожи. Также им предложили купон на поездку в такси от сервиса Didi Kuaidi, чтобы провести дополнительный тест уже в магазине. Также в этот день всем пассажиркам такси, высадившимся недалеко от торгового центра, где продавалась продукция Olay, раздавали купоны.


NIKE
На изготовление продукции от Nike по индивидуальному заказу обычно уходит несколько недель. Чтобы скрасить ожидание покупателей, Razorfish помогли Nike разработать анимацию, показывающую процесс создания дизайна. При этом ей можно поделиться в WeChat и добавить кнопку «купить».




химическая фомула О2 (кислород 2)- это формула чего?
формула молекулы кислорода
формула газа кислорода
Ну O2-это 2 атома кислорода!!!
двухвалентный О.
Вроде углекислый газ.. . Или пропан, не помню…
Молекула кислорода, в природе всегда состоит из двух атомов!
O2 — это формула молекулярного кислорода. Существует в условиях лаборатории и чрезвычайно активный атомарный кислород, он имеет вид O-
Монооксид углерода — Википедия
| Монооксид углерода | |||
|---|---|---|---|
| |||
| Систематическое наименование | Монооксид углерода | ||
| Хим. формула | CO | ||
| Рац. формула | CO | ||
| Состояние | бесцветный газ | ||
| Молярная масса | 28,01 г/моль | ||
| Плотность | 0,001250°C; 0,814-195°C г/см³ | ||
| Энергия ионизации | 14,01 ± 0,01 эВ[2] | ||
| Температура | |||
| • плавления | −205 °C | ||
| • кипения | −191,5 °C | ||
| Пределы взрываемости | 12,5 ± 0,1 об.%[2] | ||
| Энтальпия | |||
| • образования | −110,52 кДж/моль | ||
| Давление пара | 35 ± 1 атм[2] | ||
| Растворимость | |||
| • в воде | 0,0026 г/100 мл | ||
| Рег. номер CAS | 630-08-0 | ||
| PubChem | 281 | ||
| Рег. номер EINECS | 211-128-3 | ||
| SMILES | |||
| InChI | |||
| RTECS | FG3500000 | ||
| ChEBI | 17245 | ||
| Номер ООН | 1016 | ||
| ChemSpider | 275 | ||
| Токсичность | Высокотоксичен, СДЯВ | ||
| Пиктограммы ECB |    | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
углеро́да (уга́рный газ, о́кись углеро́да, оксид углерода(II)) — бесцветный чрезвычайно токсичный газ без вкуса и запаха, легче воздуха (при нормальных условиях). Химическая формула — CO.
Молекула CO имеет тройную связь, как и молекула азота N2. Так как эти молекулы сходны по строению (изоэлектронны, двухатомны, имеют близкую молярную массу), то и свойства их также схожи — очень низкие температуры плавления и кипения, близкие значения стандартных энтропий и т. п.
В рамках метода валентных связей строение молекулы CO можно описать формулой » :C≡O: «.
Согласно методу молекулярных орбиталей электронная конфигурация невозбуждённой молекулы CO σ2
Oσ2
zπ4
x, y σ2
C. Тройная связь образована σ-связью, образованной за счёт σz электронной пары, а электроны дважды вырожденного уровня πx, y соответствуют двум π-связям. Электроны на несвязывающих σC-орбитали и σO-орбитали соответствуют двум электронным парам, одна из которых локализована у атома углерода, другая — у атома кислорода.
Благодаря наличию тройной связи молекула CO весьма прочна (энергия диссоциации 1069 кДж/моль, или 256 ккал/моль, что больше, чем у любых других двухатомных молекул) и имеет малое межъядерное расстояние (dC≡O=0,1128 нм или 1,13 Å).
Молекула слабо поляризована, её электрический дипольный момент μ = 0,04⋅10−29 Кл·м. Многочисленные исследования показали, что отрицательный заряд в молекуле CO сосредоточен на атоме углерода C−←O+ (направление дипольного момента в молекуле противоположно предполагавшемуся ранее). Энергия ионизации 14,0 эВ, силовая константа связи k = 18,6.
Оксид углерода(II) представляет собой бесцветный газ без вкуса и запаха. Горюч. Так называемый «запах угарного газа» на самом деле представляет собой запах органических примесей.
Основными типами химических реакций, в которых участвует оксид углерода(II), являются реакции присоединения и окислительно-восстановительные реакции, в которых он проявляет восстановительные свойства.
При комнатных температурах CO малоактивен, его химическая активность значительно повышается при нагревании и в растворах. Так, в растворах он восстанавливает соли Au, Pt, Pd и других до металлов уже при комнатной температуре. При нагревании восстанавливает и другие металлы, например CO + CuO → Cu + CO2↑. Это широко используется в пирометаллургии. На реакции CO в растворе с хлоридом палладия основан способ качественного обнаружения CO, см. ниже.
Окисление СО в растворе часто идёт с заметной скоростью лишь в присутствии катализатора. При подборе последнего основную роль играет природа окислителя. Так, KMnO4 быстрее всего окисляет СО в присутствии мелкораздробленного серебра, K2Cr2O7 — в присутствии солей ртути, KClO3 — в присутствии OsO4. В общем, по своим восстановительным свойствам СО похож на молекулярный водород.
Ниже 830 °C более сильным восстановителем является CO, — выше — водород. Поэтому равновесие реакции
- h3O+CO⇄CO2+h3{\displaystyle {\mathsf {H_{2}O+CO\rightleftarrows CO_{2}+H_{2}}}}
до 830 °C смещено вправо, выше 830 °C влево.
Интересно, что существуют бактерии, способные за счёт окисления СО получать необходимую им для жизни энергию.
Оксид углерода(II) горит пламенем синего цвета[3] (температура начала реакции 700 °C) на воздухе:
- 2CO+O2→2CO2{\displaystyle {\mathsf {2CO+O_{2}\rightarrow 2CO_{2}}}} (ΔG°298 = −257 кДж, ΔS°298 = −86 Дж/K).
Температура горения CO может достигать 2100 °C. Реакция горения является цепной, причём инициаторами служат небольшие количества водородсодержащих соединений (вода, аммиак, сероводород и др.)
Благодаря такой хорошей теплотворной способности, CO является компонентом разных технических газовых смесей (см., например генераторный газ), используемых, в том числе, для отопления. В смеси с воздухом взрывоопасен; нижний и верхний концентрационные пределы распространения пламени: от 12,5 до 74 % (по объёму)[4].
Оксид углерода(II) реагирует с галогенами. Наибольшее практическое применение получила реакция с хлором:
- CO+Cl2→hνCOCl2.{\displaystyle {\mathsf {CO+Cl_{2}{\xrightarrow {h\nu }}COCl_{2}}}.}
Реакция экзотермическая, её тепловой эффект 113 кДж, в присутствии катализатора (активированный уголь) она идёт уже при комнатной температуре. В результате реакции образуется фосген — вещество, получившее широкое распространение в разных отраслях химии (а также как боевое отравляющее вещество). По аналогичным реакцииям могут быть получены COF2 (карбонилфторид) и COBr2 (карбонилбромид). Карбонилиодид не получен. Экзотермичность реакций быстро снижается от F к I (для реакций с F2 тепловой эффект 481 кДж, с Br2 — 4 кДж). Можно также получать и смешанные производные, например COFCl (подробнее см. галогенпроизводные угольной кислоты).
Реакцией CO с F2, кроме карбонилфторида COF2, можно получить перекисное соединение (FCO)2O2. Его характеристики: температура плавления −42 °C, кипения +16 °C, обладает характерным запахом (похожим на запах озона), при нагревании выше 200 °C разлагается со взрывом (продукты реакции CO2, O2 и COF2), в кислой среде реагирует с иодидом калия по уравнению:
- (FCO)2O2+2KI→2KF+I2+2CO2.{\displaystyle {\mathsf {(FCO)_{2}O_{2}+2KI\rightarrow 2KF+I_{2}+2CO_{2}.}}}
Оксид углерода(II) реагирует с халькогенами. С серой образует сероксид углерода COS, реакция идёт при нагревании, по уравнению:
- CO+S→COS{\displaystyle {\mathsf {CO+S\rightarrow COS}}} (ΔG°298 = −229 кДж, ΔS°298 = −134 Дж/K).
Получены также аналогичные селеноксид углерода COSe и теллуроксид углерода COTe.
Восстанавливает SO2:
- 2CO+SO2→2CO2+S.{\displaystyle {\mathsf {2CO+SO_{2}\rightarrow 2CO_{2}+S.}}}
C переходными металлами образует горючие и ядовитые соединения — карбонилы,
такие как [Fe(CO)5], [Cr(CO)6], [Ni(CO)4], [Mn2(CO)10], [Co2(CO)9] и др. Некоторые из них летучие.
- nCO+Me→[Me(CO)n]{\displaystyle {\mathsf {nCO+Me\rightarrow [Me(CO)_{n}]}}}
Оксид углерода(II) незначительно растворяется в воде, однако не реагирует с ней. Также он не вступает в реакции с растворами щелочей и кислот. Однако реагирует с расплавами щелочей с образованием соответствующих формиатов:
- CO+KOH→HCOOK.{\displaystyle {\mathsf {CO+KOH\rightarrow HCOOK.}}}
Интересна реакция оксида углерода(II) с металлическим калием в аммиачном растворе. При этом образуется взрывчатое соединение диоксодикарбонат калия:
- 2K+2CO→K2C2O2.{\displaystyle {\mathsf {2K+2CO\rightarrow K_{2}C_{2}O_{2}.}}}
Реакцией с аммиаком при высоких температурах можно получить важное для промышленности соединение — циановодород HCN. Реакция идёт в присутствии катализатора (диоксид тория ThO2) по уравнению:
- CO+Nh4→h3O+HCN.{\displaystyle {\mathsf {CO+NH_{3}\rightarrow H_{2}O+HCN.}}}
Важнейшим свойством оксида углерода(II) является его способность реагировать с водородом с образованием органических соединений (процесс синтеза Фишера — Тропша):
- xCO+yh3→{\displaystyle {\mathsf {xCO+yH_{2}\rightarrow }}} спирты + линейные алканы.
Этот процесс является источником производства таких важнейших промышленных продуктов как метанол, синтетическое дизельное топливо, многоатомные спирты, масла и смазки.
Токсичность[править | править код]
Угарный газ очень токсичен.
TLV (предельная пороговая концентрация, США): 25 ppm; 29 мг/м³ (как TWA — среднесменная концентрация, США) (ACGIH 1994—1995). MAC (максимальная допустимая концентрация, США): 30 ppm; 33 мг/м³; Беременность: B (вредный эффект вероятен даже на уровне MAK) (1993). ПДКр.з. по Гигиеническим нормативам ГН 2.2.5.1313—03 составляет 20 мг/м³ (около 0,0017 %).
В выхлопе бензинового автомобиля допускается до 1,5-3 % (допустимая концентрация сильно различается в зависимости от страны/применяемых стандартов; а 3% — много даже для старого карбюраторного автомобиля без катализатора).
По классификации ООН оксид углерода(II) относится к классу опасности 2,3, вторичная опасность по классификации ООН: 2,1.
Угарный газ очень опасен, так как не имеет запаха и вызывает отравление и даже смерть.[5] Признаки отравления: головная боль и головокружение; отмечается шум в ушах, одышка, учащённое сердцебиение, мерцание перед глазами, покраснение лица, общая слабость, тошнота, иногда рвота; в тяжёлых случаях судороги, обморочное отношение к людям, кома[6][3].
Токсическое действие оксида углерода(II) обусловлено образованием карбоксигемоглобина — значительно более прочного карбонильного комплекса с гемоглобином, по сравнению с комплексом гемоглобина с кислородом (оксигемоглобином)[6]. Таким образом, блокируются процессы транспортировки кислорода и клеточного дыхания. Концентрация в воздухе более 0,1 % приводит к смерти в течение одного часа[6].
Опыты на молодых крысах показали, что концентрация CO в воздухе 0,02 % замедляет их рост и снижает активность по сравнению с контрольной группой.
Помощь при отравлении оксидом углерода(II)[править | править код]
Соединение окиси углерода с гемоглобином обратимо. При отравлении рекомендуются следующие действия[6]:
- Пострадавшего следует вынести на свежий воздух. При отравлении лёгкой степени достаточно гипервентиляции лёгких кислородом.
- Искусственная вентиляция лёгких, О2-терапия, в том числе в барокамере.
- Ацизол, хромосмон внутривенно.
Мировой медицине неизвестны надежные антидоты для применения в случае отравления угарным газом[7].
Защита от оксида углерода(II)[править | править код]
CO очень слабо поглощается активированным углём обычных фильтрующих противогазов, поэтому для защиты от него применяется специальный фильтрующий элемент (он может также подключаться дополнительно к основному) — гопкалитовый патрон. Гопкалит представляет собой катализатор, способствующий окислению CO в CO2 при нормальных температурах. Недостатком использования гопкалита является то, что при его применении приходится вдыхать нагретый в результате реакции воздух. Обычный способ защиты — использование изолирующего дыхательного аппарата[3].
Эндогенный монооксид углерода[править | править код]
Эндогенный монооксид углерода вырабатывается в норме клетками организма человека и животных и выполняет функцию сигнальной молекулы. Он играет известную физиологическую роль в организме, в частности, является
нейротрансмиттером и вызывает вазодилатацию[8]. Ввиду роли эндогенного угарного газа в организме, нарушения его метаболизма связывают с различными заболеваниями, такими, как нейродегенеративные заболевания, атеросклероз кровеносных сосудов, гипертоническая болезнь, сердечная недостаточность, различные воспалительные процессы[8].
Эндогенный угарный газ образуется в организме благодаря окисляющему действию фермента гемоксигеназы на гем, являющийся продуктом разрушения гемоглобина и миоглобина, а также других гемосодержащих белков. Этот процесс вызывает образование в крови человека небольшого количества карбоксигемоглобина, даже если человек не курит и дышит не атмосферным воздухом (всегда содержащим небольшие количества экзогенного угарного газа), а чистым кислородом или смесью азота с кислородом.
Вслед за появившимися в 1993 году первыми данными о том, что эндогенный угарный газ является нормальным нейротрансмиттером в организме человека[9][10], а также одним из трёх эндогенных газов, которые в норме модулируют течение воспалительных реакций в организме (два других — оксид азота (II) и сероводород), эндогенный угарный газ привлёк значительное внимание клиницистов и исследователей как важный биологический регулятор. Было показано, что во многих тканях все три вышеупомянутых газа являются противовоспалительными веществами, вазодилататорами, а также вызывают ангиогенез[11]. Однако не всё так просто и однозначно. Ангиогенез — не всегда полезный эффект, поскольку он, в частности, играет роль в росте злокачественных опухолей, а также является одной из причин повреждения сетчатки при макулярной дегенерации. В частности, курение (основной источник угарного газа в крови, дающий в несколько раз большую концентрацию его, чем естественная продукция) повышает риск макулярной дегенерации сетчатки в 4-6 раз.
Существует теория о том, что в некоторых синапсах нервных клеток, где происходит долговременное запоминание информации, принимающая клетка в ответ на принятый сигнал вырабатывает эндогенный угарный газ, который передаёт сигнал обратно передающей клетке, чем сообщает ей о своей готовности и в дальнейшем принимать сигналы от неё и повышая активность клетки-передатчика сигнала. Некоторые из этих нервных клеток содержат гуанилатциклазу, фермент, который активируется при воздействии эндогенного угарного газа[10].
Исследования, посвящённые роли эндогенного угарного газа как противовоспалительного вещества и цитопротектора, проводились во множестве лабораторий по всему миру. Эти свойства эндогенного угарного газа делают воздействие на его метаболизм интересной терапевтической мишенью для лечения таких разных патологических состояний, как повреждение тканей, вызванное ишемией и последующей реперфузией (а это, например, инфаркт миокарда, ишемический инсульт), отторжение трансплантата, атеросклероз сосудов, тяжёлый сепсис, тяжёлая малярия, аутоиммунные заболевания. Проводились в том числе и клинические испытания на человеке, однако результаты их пока ещё не опубликованы[12].
На 2015 год о роли эндогенного угарного газа в организме известно следующее[13]:
- Эндогенный угарный газ — одна из важных эндогенных сигнальных молекул;
- Эндогенный угарный газ модулирует функции ЦНС и сердечно-сосудистой системы;
- Эндогенный угарный газ ингибирует агрегацию тромбоцитов и их адгезию к стенкам сосудов;
- Влияние на обмен эндогенного угарного газа в будущем может быть одной из важных терапевтических стратегий при ряде заболеваний.
Токсичность дыма, выделяющегося при горении угля, была описана ещё Аристотелем и Галеном.
Оксид углерода(II) был впервые получен французским химиком Жаком де Лассоном в 1776 при нагревании оксида цинка с углём, но первоначально его ошибочно приняли за водород, так как он сгорал синим пламенем.
То, что в состав этого газа входит углерод и кислород, выяснил в 1800 английский химик Вильям Крюйкшенк. Токсичность газа была исследована в 1846 году французским медиком Клодом Бернаром в опытах на собаках[14].
Оксид углерода(II) вне атмосферы Земли впервые был обнаружен бельгийским учёным М. Мижотом (M. Migeotte) в 1949 году по наличию основной колебательно-вращательной полосы в ИК-спектре Солнца. Оксид углерода(II) в межзвёздной среде был обнаружен в 1970 г.[15]
Промышленный способ[править | править код]
Влияние температуры на равновесие реакции: CO2+C⇄2CO{\displaystyle {\mathsf {CO_{2}+C\rightleftarrows 2CO}}}
- 2C+O2→2CO{\displaystyle {\mathsf {2C+O_{2}\rightarrow 2CO}}} (тепловой эффект этой реакции 220 кДж),
- CO2+C⇄2CO{\displaystyle {\mathsf {CO_{2}+C\rightleftarrows 2CO}}} (ΔH = 172 кДж, ΔS = 176 Дж/К)
Эта реакция происходит при печной топке, когда слишком рано закрывают печную заслонку (пока окончательно не прогорели угли). Образующийся при этом оксид углерода(II) вследствие своей ядовитости вызывает физиологические расстройства («угар») и даже смерть (см. ниже), отсюда и одно из тривиальных названий — «угарный газ»[3].
Реакция восстановления диоксида углерода обратимая, влияние температуры на состояние равновесия этой реакции приведено на графике. Протекание реакции вправо обеспечивает энтропийный фактор, а влево — энтальпийный. При температуре ниже 400 °C равновесие практически полностью сдвинуто влево, а при температуре выше 1000 °C вправо (в сторону образования CO). При низких температурах скорость этой реакции очень мала, поэтому оксид углерода(II) при нормальных условиях вполне устойчив. Это равновесие носит специальное название равновесие Будуара.
Лабораторный способ[править | править код]
- HCOOH→h3SO4oth3O+CO.{\displaystyle {\mathsf {HCOOH{\xrightarrow[{H_{2}SO_{4}}]{^{o}t}}H_{2}O+CO.}}}
- Можно также обработать муравьиную кислоту хлорсульфоновой. Эта реакция идёт уже при обычной температуре по схеме:
- HCOOH+ClSO3H→h3SO4+HCl+CO↑.{\displaystyle {\mathsf {HCOOH+ClSO_{3}H\rightarrow H_{2}SO_{4}+HCl+CO\uparrow .}}}
- h3C2O4→h3SO4otCO↑+CO2↑+h3O.{\displaystyle {\mathsf {H_{2}C_{2}O_{4}{\xrightarrow[{H_{2}SO_{4}}]{^{o}t}}CO\uparrow +CO_{2}\uparrow +H_{2}O.}}}
- K4[Fe(CN)6]+6h3SO4+6h3O→ot2K2SO4+FeSO4+3(Nh5)2SO4+6CO↑.{\displaystyle {\mathsf {K_{4}[Fe(CN)_{6}]+6H_{2}SO_{4}+6H_{2}O{\xrightarrow[{}]{^{o}t}}2K_{2}SO_{4}+FeSO_{4}+3(NH_{4})_{2}SO_{4}+6CO\uparrow .}}}
- Mg+ZnCO3→otMgO+ZnO+CO↑.{\displaystyle {\mathsf {Mg+ZnCO_{3}{\xrightarrow[{}]{^{o}t}}MgO+ZnO+CO\uparrow .}}}
Качественно можно определить наличие CO по потемнению растворов хлорида палладия (или пропитанной этим раствором бумаги). Потеменение связано с выделением мелкодисперсного металлического палладия по схеме:
- PdCl2

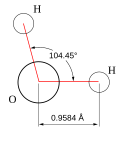
 (
(

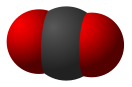 (
(
 (
(